水生所在蓝细菌赖氨酸单甲基化修饰研究中取得重要进展
蛋白质翻译后修饰通过在一个或者几个氨基酸残基上加上化学修饰基团而改变蛋白质的结构和功能,参与蛋白质的活性状态、定位、折叠以及蛋白质-蛋白质间相互作用。赖氨酸甲基化是常见的蛋白质翻译后修饰类型之一,其调控机制复杂,在生命调控过程中地位重要,尤其在真核生物中的组蛋白上发生的甲基化修饰,对异染色质形成、基因印记和转录过程有着重要的调控作用。目前在真核生物中已报道了多种能够催化关键细胞因子发生赖氨酸甲基化的修饰酶,并对各种关键通路进行精确的调节。但是,对原核生物中的赖氨酸甲基化修饰的功能却知之甚少,特别是在蓝细菌中,赖氨酸单甲基化修饰和甲基转移酶是否存在?这些甲基化修饰与转移酶具有怎样的功能?目前都是未知。
中国科学院水生生物研究所水生生物蛋白质组学课题组首先证实赖氨酸单甲基化修饰在藻类和植物中普遍存在,通过发展赖氨酸单甲基化蛋白质丙酰化修饰技术,结合修饰肽段富集与质谱鉴定等方法,实现了模式蓝细菌集胞藻PCC6803赖氨酸单甲基化修饰蛋白的系统性鉴定。本研究共鉴定到376个赖氨酸单甲基化位点,分布于270个蛋白质中;这些修饰蛋白在光合作用以及能量代谢通路中广泛分布,提示了赖氨酸单甲基化修饰在光合系统以及能量代谢等生物学过程中发挥着重要的调控作用(图1)。
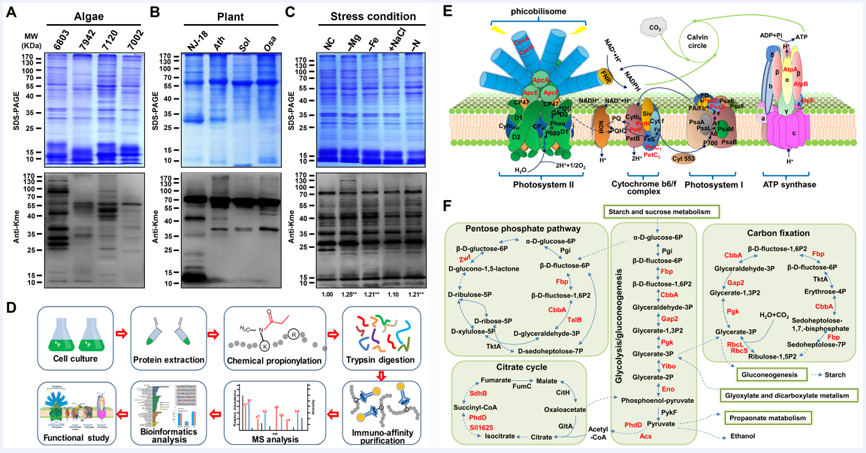
图1、赖氨酸单甲基化修饰在光合生物中普遍存在并参与蓝细菌光合作用与代谢过程
该研究通过蛋白序列保守性和结构域分析发现,集胞藻PCC6803中的CpcM蛋白具有保守的甲基转移酶结构域,深入的功能实验证实,该酶具有催化赖氨酸甲基化的能力;同时,cpcM基因敲除后,蓝细菌中赖氨酸甲基化修饰水平显著降低。为了鉴定CpcM的作用靶标,研究团队利用高通量质谱技术,鉴定到CpcM蛋白酶的多个靶标底物蛋白(图2)。
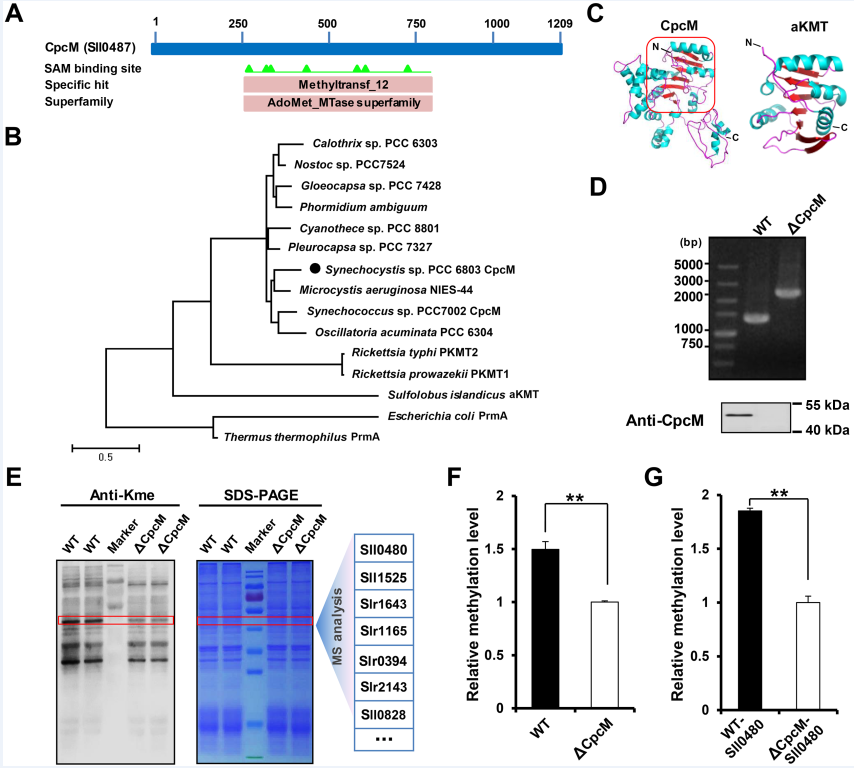
图2、蓝细菌中赖氨酸甲基转移酶CpcM的鉴定
进一步酶活性测定实验表明,CpcM能够改变靶标底物Sll0480(天冬氨酸氨基转移酶)的赖氨酸甲基化状态从而影响Sll0480的转氨酶活性(图3)。
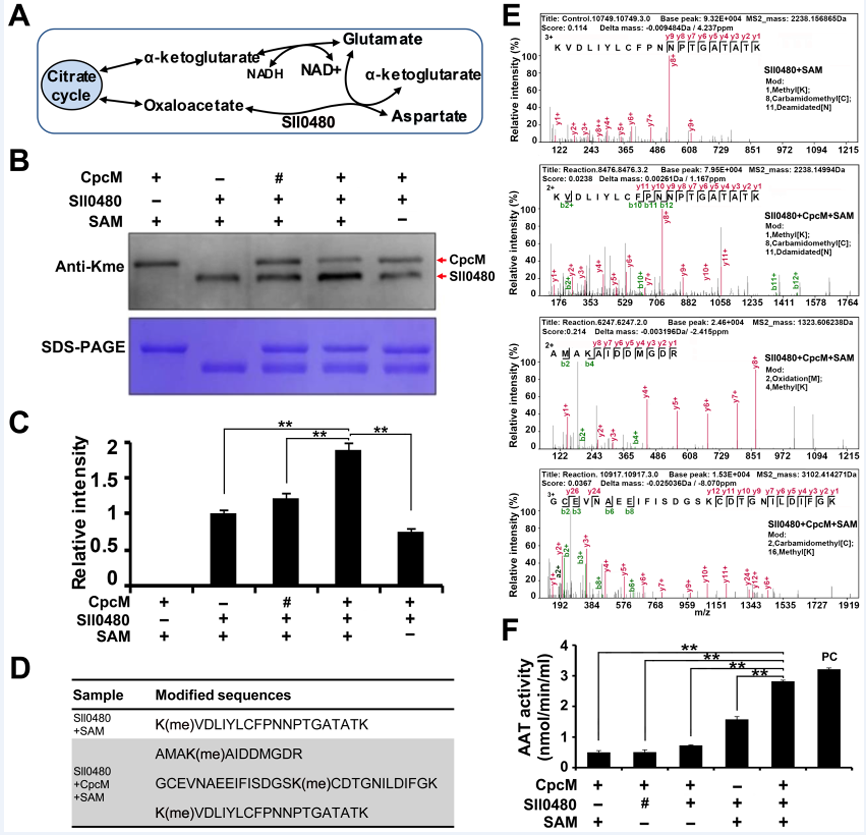
图3、CpcM调控底物蛋白甲基化修饰状态,影响底物蛋白酶的活性
此外,该研究还发现,cpcM基因敲除后将导致蓝细菌光合作用过程中的能量与电子传递受到显著影响,表明CpcM蛋白通过调控重要底物蛋白的甲基化修饰状态影响蓝细菌的能量代谢等过程。该研究报道了光合生物中首个赖氨酸单甲基化修饰蛋白组数据,为光合生物中赖氨酸甲基化研究提供了可靠的数据支持。该研究还首次发现并揭示了蓝细菌中赖氨酸甲基转移酶的功能与作用机制,为研究赖氨酸甲基化修饰在光合生物中的功能提供新的研究思路。
研究成果“Characterization of Lysine Monomethylome and Methyltransferase in Model Cyanobacterium Synechocystis sp. PCC 6803”在线发表在Genomics, Proteomics & Bioinformatics杂志,水生所博士生林小煌(现为福建医科大学讲师)和高级实验师杨明坤为该论文的共同第一作者,水生所葛峰研究员为通讯作者。该研究得到自然科学基金和中科院关键技术人才项目的资助。
文章链接:https://www.sciencedirect.com/science/article/pii/S1672022918302249
